DIALISIS:
La diálisis es un proceso por medio del cual se produce un filtrado artificial de la sangre. En éste, se retiran los elementos tóxicos del torrente sanguíneo cuando los riñones han perdido su capacidad. Este sistema suele utilizarse en pacientes que padecen de insuficiencia renal, pero también sirve para remover de manera más rápida las drogas o sustancias tóxicas en situaciones agudas.
Cuando una persona ha perdido el 90 por ciento de la función renal, se le considera un enfermo de insuficiencia renal crónica. Para este caso existen dos tipos de diálisis: la hemodiálisis y la diálisis peritoneal.
La diálisis peritoneal elimina las toxinas del organismo por medio de una membrana que recubre los órganos de la cavidad abdominal llamada peritoneo. En este tipo, se le infunden soluciones especiales que contribuyen con la eliminación de las toxinas, se mantienen ahí por un lapso de tiempo y luego son drenadas. Este tipo de diálisis puede hacerse desde la casa, pero debe realizarse todos los días.
En la hemodiálisis, la sangre pasa a través de un aparato que realiza el filtrado. La mayoría de los pacientes se someten a hemodiálisis durante 3 sesiones cada semana y cada sesión dura de 3 a 4 horas. En cuanto a su efectividad, ambos sistemas son iguales, sin embargo los pacientes tienden a preferir este último.
Antes de realizar una diálisis es fundamental controlar: la presión sanguínea, la temperatura, la frecuencia cardíaca, la frecuencia respiratoria, el peso, hacer una evaluación del tórax y un examen del acceso venoso. Es importante tener en consideración que el proceso es bastante largo y tedioso. En el caso de los niños es especialmente necesario disponer de juegos o elementos que los distraigan como libros o programas de televisión.
Los riesgos inmediatos que implica la diálisis son: hipotensión, infecciones, desequilibrio de electrolitos, sangrado en el sitio del acceso, náuseas y vómitos, calambres, reacción al dializador, embolia gaseosa, e isquemia o arritmia cardíaca (se refiere a los latidos cardíacos irregulares)
OSMOSIS:
La
ósmosis u
osmosis es un
fenómeno físico-químico que hace referencia al paso de disolvente, pero no de soluto, entre dos disoluciones de distinta concentración separadas por una
membrana semipermeable. La ósmosis es un fenómeno biológico de importancia para la fisiología celular de los seres vivos.
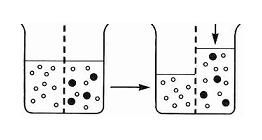
Una membrana semipermeable es aquella que contiene
poros de tamaño molecular. El tamaño de los poros es minúsculo, por lo que dejan pasar las moléculas pequeñas pero no las grandes. Si una de estas membranas separa un líquido en dos particiones, por ejemplo una de agua pura y otra de agua con azúcar, suceden distintos fenómenos que son explicados con los conceptos de
potencial electroquímico y
difusión simple.
Los potenciales químicos de los componentes de una solución son menores que la suma del potencial de dichos componentes cuando no están ligados en la solución. Este desequilibrio hace que se produzca un flujo de partículas solventes hacia la zona de menor potencial, que se expresa como
presión osmótica mensurable en términos de presión atmosférica. El solvente fluirá hacia el soluto hasta equilibrar dicho potencial o hasta que la presión hidrostática equilibre la presión osmótica.
Como resultado final, el agua pasa de la zona de baja concentración a la de alta concentración y viceversa, con un
flujo neto mayor de moléculas de agua que pasan desde la zona de baja concentración a la de alta.
Por otra parte, el concepto de ósmosis se utiliza para nombrar a la
mutua influencia entre dos
personas o grupos de personas, especialmente en el campo de las
ideas.






 Una membrana semipermeable es aquella que contiene poros de tamaño molecular. El tamaño de los poros es minúsculo, por lo que dejan pasar las moléculas pequeñas pero no las grandes. Si una de estas membranas separa un líquido en dos particiones, por ejemplo una de agua pura y otra de agua con azúcar, suceden distintos fenómenos que son explicados con los conceptos de potencial electroquímico y difusión simple.
Una membrana semipermeable es aquella que contiene poros de tamaño molecular. El tamaño de los poros es minúsculo, por lo que dejan pasar las moléculas pequeñas pero no las grandes. Si una de estas membranas separa un líquido en dos particiones, por ejemplo una de agua pura y otra de agua con azúcar, suceden distintos fenómenos que son explicados con los conceptos de potencial electroquímico y difusión simple.
